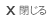初めに
「ブレイクスルー」は、いい言葉だ。日本語では「突破口」。「飛躍的進歩」とも表せよう。新しい技術の開発に携わる人は皆この言葉に憧れているし、その恩恵にあずかる人にとっても大変ありがたい言葉だ。がんの治療の世界で、今世紀に入ってから、まさにそのブレイクスルーが起こった。
2018年、ジム・アリソン氏と本庶佑氏が「がん免疫療法の開発」でノーベル生理学・医学賞を受賞した。このノーベル賞は、そのブレイクスルーに対して与えられたものだ。
転移のない初発のがんであれば、外科的切除、放射線照射、抗がん剤などで根治を望むことができる。しかし、転移巣のあるがん患者や、再発したがん患者に対しては、上記の三大療法は、ほぼ無力である。患者にとって「転移」「再発」と告げられることは死刑宣告に近い。ところが、免疫療法は違う。転移巣があろうが、再発であろうが、効く時は効くのだ。がんを免疫療法で治すことは、永らく人類の悲願であった。
本書は、そのブレイクスルーに至るまでの、100年以上にわたるがん免疫療法の歴史の解説書だ。医学的な解説書としても貴重だが、その歴史に関わってきた人たちが織りなすドラマが丁寧に描写されているのがいい。ブレイクスルーをもたらした研究者と医師だけでなく、患者やその家族も登場する。そのおかげで、ヒリヒリするような臨場感が感じられる。
抗CTLA-4抗体の開発に至るまで
長い間、がん免疫療法は、ごく一部の例外的なケースを除いて、標準治療として使われることはなかった。しかし、がん免疫療法は、まったく効いていなかったわけではない。わずかではあっても明らかに治る人が現れると、その治療を施してきた医師は、「何かある」と気がつく。だから、一部の研究者と医師は、「いつかきっと」という信念の元に、がん免疫療法の開発を続けてきたのだ。
まず20世紀の初頭にコーリーという医師が、感染症を患った時にがんが治ったというがん患者に出会って、「免疫を活性化したらがんが治ることがある」と気がついた。やがてコーリー氏はがん患者に細菌そのものあるいは細菌に由来する毒素を投与する治療を始めた。これは標準療法にはならなかったが、オールド氏がそのコンセプトを引き継ぎ、多くの弟子を育てた。ローゼンバーグ氏は、1980年代以後、免疫反応の中で主たる攻撃部隊の役割を果たすT細胞をサイトカインで活性化する方法で、一定の効果を示すまでにたどり着き、大きな話題にもなった。しかし、標準療法には至らなかった。
何かが免疫反応の邪魔をしていた。本書は、人類がそれに気がつく過程を丁寧に描いている。最初に気がついたのはアリソン氏。彼はCTLA-4という分子が免疫を抑制して治療の邪魔をしていることに気がついた。そして1996年、この分子の作用をブロックできる抗体を投与したマウスでがんが治ることを示した。つまり、「がんは免疫で治せる」ことを証明した。この功績はまさにブレイクスルーだ。そして開発されたヒト用の抗CTLA-4抗体の臨床試験では、新しい評価法を採用する必要があった。ここにも大きなブレイクスルーがあった。とてもスリリングな展開だ。
抗PD-1抗体の開発過程
その後、CTLA-4とは異なる仕組みで免疫を抑制する働きを持つPD-1という分子に対する抗体が開発され、こちらの方がより広く使われるようになった。しかし、本書では抗PD-1抗体に関しての記述は相対的に少ない。確かに、ブレイクスルーの本体は抗CTLA-4抗体でなされており、抗PD-1抗体は同じ方法論に乗っかって開発されたと言えよう。本書は人類がブレイクスルーに至った過程に焦点を当てているので、こういう扱いになっている。そういう論点から、「本庶佑はPD-1を発見しさらにPD-1が免疫を抑制することを解明した」とは書かれているが、がん免疫療法の開発への貢献に関してはほとんど書かれていない。日本人の読者は、この点について少し寂しく思うかもしれない。しかし、本書はがん免疫療法の開発研究をライフワークとしてきた人たちに焦点を当てており、一方本庶氏が研究者人生で力を入れてきたのは腫瘍免疫学ではなかったのだから、こういう描かれ方になるのは仕方がないであろう。
本庶氏は、抗体分子が目的に応じて機能を変更する「クラススイッチ」という重要な現象の仕組みを解明し、さらにそのクラススイッチを司る遺伝子AIDを発見したという、ノーベル賞級の業績をあげている。このAIDという分子は、クラススイッチに関わるだけではなく、抗原への結合力が強い高品質な抗体を産生する過程にも関与している。さらに脊椎動物全体で見ると、抗体分子の「多様性を作る仕組み」として、利根川進氏が解明した遺伝子再構成という現象に匹敵する、あるいはそれ以上に重要な役割を担っていることがわかっている。これらのクラススイッチとAIDに関連する仕事こそが本庶氏の真骨頂であり、腫瘍免疫における貢献よりもむしろこの業績をもって人類史に記憶されるべき研究者である。
抗CTLA-4抗体と抗PD-1抗体の作用機序
ここで、抗CTLA-4抗体と抗PD-1抗体がどうやって効いているかを解説しておこう。がんの目印(がん抗原)を取り込んだ樹状細胞が、その目印を標的に働けるキラーT細胞を活性化し、活性化されたキラーT細胞ががん細胞に攻撃を加える(図1A)。しかし、がんは免疫を逃れようとする。そのためのメカニズムの一つが、制御性T細胞だ。制御性T細胞は樹状細胞と結合することにより、キラーT細胞の活性化の邪魔をする(図1B)。この時、制御性T細胞が発現するCTLA-4分子が重要な働きをしている。一方、がん細胞はPD-L1という分子を発現して、キラーT細胞が出しているPD-1に抑制性シグナルを送り、キラーT細胞の活動を抑制する(図1B)。このような状態の時に、抗CTLA-4抗体あるいは抗PD-1抗体を加えると、これらの抑制性のメカニズムを解除することができる(図1C)。それで、キラーT細胞ががんを攻撃できるようになる(図1D)。CTLA-4やPD-1の抑制性分子を免疫チェックポイント分子と呼び、その阻害抗体製剤を、免疫チェックポイント阻害剤(immune checkpoint blockade)と呼ぶ。
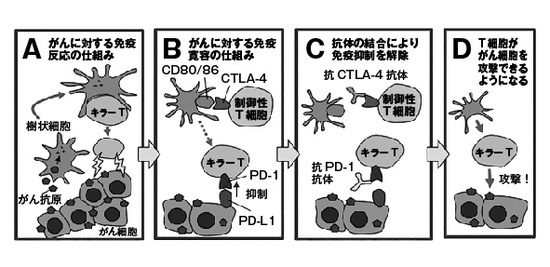
排除、平衡、逃避
本書の特筆すべき点として、基礎系の腫瘍免疫学者であるシュライバー氏の仕事に焦点を当てていることが挙げられる。ここでそのシュライバー氏がオールド氏と共に提唱した「3つのE」(第5章)について解説しておこう(図2)。3つのEとは、排除(Elimination)、平衡(Equilibrium)、逃避(Escape)である。がん細胞は、がん特有の標的分子(がん抗原)を出していることが多い。発生するとまず免疫が排除する(排除相)。しかし、がん細胞の中に、免疫を抑制する仕組みを味方につける能力を持つものが現れる。そういうがん細胞は、免疫系の監視の中で、潜むようにして生き続ける(平衡相)。そのようながん細胞の一部は、やがてがん抗原を失う、あるいはより強い免疫抑制の仕組みを味方につけるようになる。そういう細胞は、免疫系の攻撃に抗い、増殖して、ついに「がん」として発症する(逃避相)。免疫ががん細胞を監視しているので、がん免疫監視機構(cancer immunosurveillance)と称され、がんがその監視を逃れる現象は、がん免疫編集(cancer immunoediting)と称されている。
さて、どうしてがん細胞はそういう逃避の能力を身につけることができるのだろうか。言い換えれば、どうしてそんな仕組みが生物に備わっているのだろうか。これらの仕組みは、「自己寛容」という重要な現象のために、体にあらかじめ備わっているのだ。免疫は、病原体を攻撃する役割を果たしている。しかし、間違えて自分の体を攻撃してしまわないように、抑制する仕組みが幾重にも働いている。前記の制御性T細胞やPD-1シグナルなどがそれにあたる。他にも、抑制性のミエロイド系細胞や間葉系細胞など、多種多様な免疫抑制機構が存在する。こういう仕組みをたまたま味方につけたがん細胞が、免疫系の攻撃から「逃避」できるようになるのだ。
免疫監視機構の実態
さて、前記の免疫監視機構については、注意を要する。巷間では「毎日数千個発生するがん細胞を免疫細胞が殺してくれている」「老化やストレスで免疫が低下するからがん細胞が生き延びてがんが発症する」という言説がまかり通っている。しかしながら、本書の「3つのE」の章でシュライバー氏らが述べている免疫監視機構は、そういう言説を支持するものではないことに注意されたい。「免疫ががん細胞に働きかける」ということは確かで、「がん細胞がそれを逃れて増大する」という事象が存在することも確かだ。しかし、これらの事象はすべてのがんで必ず起こるわけではない。さらに、より重要なこととして、排除相でどれくらい効率よく排除されているかは、まだ明確には計測されていない。
一方で、本書でも登場するスタットマン氏らが、40年も前に、ヌードマウスという胸腺がないために獲得免疫系がほぼ欠如したマウスで、自然発がんの頻度や、化学物質で誘発したがんの頻度が正常マウスと変わらないというデータを示している。言い換えれば、「免疫系の本体である獲得免疫系はがんの排除をしていない」ということになる。本書ではスタットマン氏のデータについて否定的な書き方(本書166ページ、「誤った前提に立って行なわれた実験が導いた誤った結果」)をされているが、決してそんなにひどいデータではなく、今でも十分評価に値する知見である。本書ではシュライバー氏が、より重度の免疫不全マウスでは自然発がんの発症頻度が高いという論文を出してスタットマン氏の知見を覆したという話が強調されているが、発症頻度が劇的に高いというわけでもなく、その論文に対する反証論文もある(Int J Cancer 131:1499, 2012)。最近作られているさらに超重度の免疫不全マウス(NOGマウスなど)でも、がんでバタバタ死ぬようなことはない。少なくとも「毎日数千個発生するがん細胞を免疫細胞が殺してくれている」という話はありえない。若い個体でがんが発症しにくいのは、主には遺伝子の傷を修復する仕組みや、異常な細胞を細胞死に導く仕組みによるものである。
なお、スタットマン氏による「がん免疫監視機構は働いていない」という知見は、がんの免疫療法を否定するものではない。スタットマン氏の知見は、「排除」がほとんど起こっていないことを示しているだけで、逃避という現象を否定している訳ではない。同じように、シュライバー氏がいう「がん免疫監視機構は働いている」という知見が、がん免疫療法推進派にとってありがたいものとも限らない。例えば抗原性を消失させて逃避したがんの場合は、免疫療法は困難だと考えられるからである。
CAR-T療法
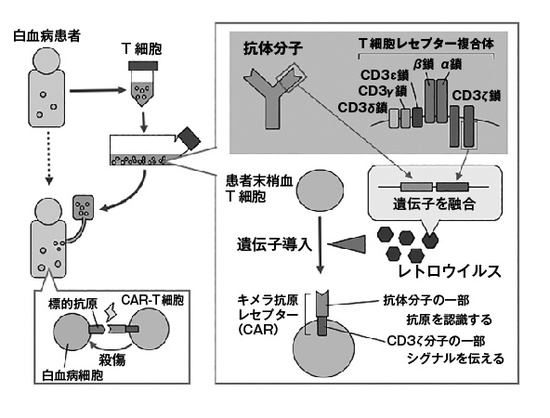
CAR-T細胞についても解説しておこう。これは抗体分子とキラーT細胞を結合させた治療法だ。昔からがんに結合できる抗体分子の根元に毒素や放射性物質をつけてがんを攻撃するという話はあったが、根元にキラーT細胞をくっつけたら、劇的に効果が見られるようになった。抗体分子にはT細胞を活性化できるように、T細胞レセプター複合体のうち、シグナルを伝える部分(CD3ζの細胞内領域)が組み合わされている(図3)。その他にも様々な工夫がしてあり、そのため「キメラ」抗原レセプター(chimeric antigen receptor: CAR)と呼ばれる。CAR遺伝子をレトロウイルスに組み込んで、患者から採取したT細胞に導入してから、その後患者に戻すという方法が取られる。現時点ではCD19という分子を標的としたCAR-T療法がB細胞性の白血病やリンパ腫に対して欧米や日本で承認されている。奏効率はとても高く、80%から90%のオーダーだ。
最後に
さて、ノーベル賞も授与され、ブレイクスルーとして大いに注目されている免疫チェックポイント阻害剤であるが、課題はある。抗CTLA-4抗体も、抗PD-1抗体も、実は特効薬というにはほど遠い。いろいろな種類のがんに対して承認されているが、奏功率はせいぜい20から30%くらいである。また、副作用として自己免疫反応が高率(80%というレベル)に出現する。さらに、一部に、投与によりむしろ急激にがんが増悪するというケースも報告されている。他に、長期的に見た場合の予後(治癒するのか、再発するのか)も、今後どういう評価になるか不明だ。一方のCAR-T療法も、本書でも書かれているように、サイトカインストームという重大な副作用が高頻度で出現する。また、CD19は良い標的分子であったが、次の標的分子がなかなか見つからず、全体として開発が順調というわけではない。
それでも、免疫チェックポイント阻害剤が「免疫療法ががんに効果がある」ということを示した功績は、はかりしれない。これまで効きが悪かった方法も、免疫チェックポイント阻害剤と組み合わせれば、相乗効果が得られるようになるかもしれない。ワクチンや養子免疫療法などのような従来のがん免疫療法との併用だけでなく、抗がん剤や放射線療法との組み合わせも試されている。一方、CAR-T療法が示した「細胞を薬として使う」という戦略は、「細胞医薬」という分野を発展させるブレイクスルーになっている。これからの数年間で、がん治療が大きく変わると期待されている。
河本宏(京都大学ウイルス・再生医科学研究所副所長、再生免疫学分野教授)